ASOURCE®TIMES

NIH/NCI(米国国立衛生研究所/国立がん研究所)
分子イメージング部門(ブランチ)分子セラノスティクス研究室 チーフ
関西医科大学 光免疫医学研究所 所長
小林 久隆
1987年京都大学医学部卒業。放射線科研修医を経たのち、1991年に同大学院内科系核医学専攻へ進学。1995年に同修了、医学博士号取得。同年に渡米しNIHクリニカル・センター核医学部門の客員研究員に。1998年に帰国し、京都大学医学部映像医療学講座助手を経て、2001年に再渡米、NIH/NCI代謝研究室のシニアフェローとして勤務。2004年から現職のNIH/NCI分子イメージングブランチの主任研究員。
米国国立衛生研究所(NIH)で日本人の小林久隆博士によって開発されたがん光免疫療法。がん細胞を攻撃する近赤外線の照射と免疫の力によってがんの治癒を目指す、世界的に注目されている治療法の研究拠点が2022年4月に日本に誕生しました。光免疫療法とは何か、その研究拠点を日本に設置した理由、そしてそこではどのような研究を進めるのか、小林博士に直接伺いました。
大阪府枚方市にある関西医科大学に2022年4月に国内初となる「光免疫医学研究所」が設置されました。がん治療といえば外科手術、薬物療法、放射線治療、免疫療法が主要な4本柱ですが、この光免疫医学研究所が集中的に研究する「光免疫療法」は第5のがん治療とされています。
関西医科大学では2021年4月に研究所に先行する形で附属病院に「光免疫療法センター」を開設し、厚生労働相に承認された頭頸部がんを対象に治療を実施しています。大学は「今回、国内初の研究所が開設されることにより、臨床と研究の両輪がそろい、さらなる治療効果の向上と適応症の拡大を推進する」という方針を表明しています。
がん光免疫療法は2011年にNIHで開発しました。論文は2011年に医学雑誌であるNature Medicineに発表し、翌年オバマ大統領(当時)による一般教書演説(施政方針演説)でも取り上げられました。
私は現在もNIHの主任研究員として研究を続けていますが、今回は、日本に研究拠点を設けた理由や、光免疫療法自体が今後どのように発展して、がんの治療を変えていこうとしているのか、についてご説明します。まずその前に、がん光免疫療法の原理と現状を見ていきましょう。
がん光免疫療法の原理自体は非常にシンプルです。
まずがん細胞の表面に露出した抗原に反応する抗体に、光に反応する薬剤を結合させた“抗体色素複合体”を作製します。これをがん患者さんに点滴で投与して、1日が経過するとがん細胞に薬剤が到達します。そこで腫瘍部位にレーザー光を照射すると抗体色素複合体が結合したがん細胞だけが破裂して死滅する、という原理です。
がん細胞の抗原を標的にした抗体療法はすでに数多くの薬剤が開発され、実際の治療に使われていますが、標的とする抗原と同じ抗原を持つ正常細胞にもダメージを与えることがあります。
ですが光免疫療法では、薬剤量が少なくて済むため抗体色素複合体が正常細胞にはあまり結合しないうえ、“レーザー光を当ててがん細胞にくっついた光に反応する物質を活性化する”という光を照射する場所を選択できる強みもあるため、正常細胞へのダメージを最小限に抑え、がんに対する極めて高い特異性を実現しています。
しかも、抗体色素複合体とレーザー光による攻撃で破壊されたがん細胞から流出したがん抗原を周囲の免疫細胞が認識・活性化することにより、がん細胞を攻撃する免疫細胞を誘導します。つまり、抗体複合体とレーザー光による直接の“1次攻撃”の後に、患者さん自身のがん免疫を活性化してがんを攻撃する“2次攻撃”が用意されている、というわけです。(図)
この最初の攻撃でがん細胞の8割から9割が消滅しますが、がんを完治させるには免疫の力が欠かせません。破壊されたがん細胞から放出されたがん特異の抗原を周辺の免疫細胞(T細胞)が認識して生き残ったがん細胞を攻撃します。光免疫療法の最大のメリットは今までの治療法に比べて副作用が少ないことに加え、このように患者さん自身の免疫細胞を強力に動員することができるため、がんの再発を抑えて転移したがん細胞にも攻撃することができる潜在能力があります。近い将来、光免疫療法は8割以上の固形がんが適応になると考えています。
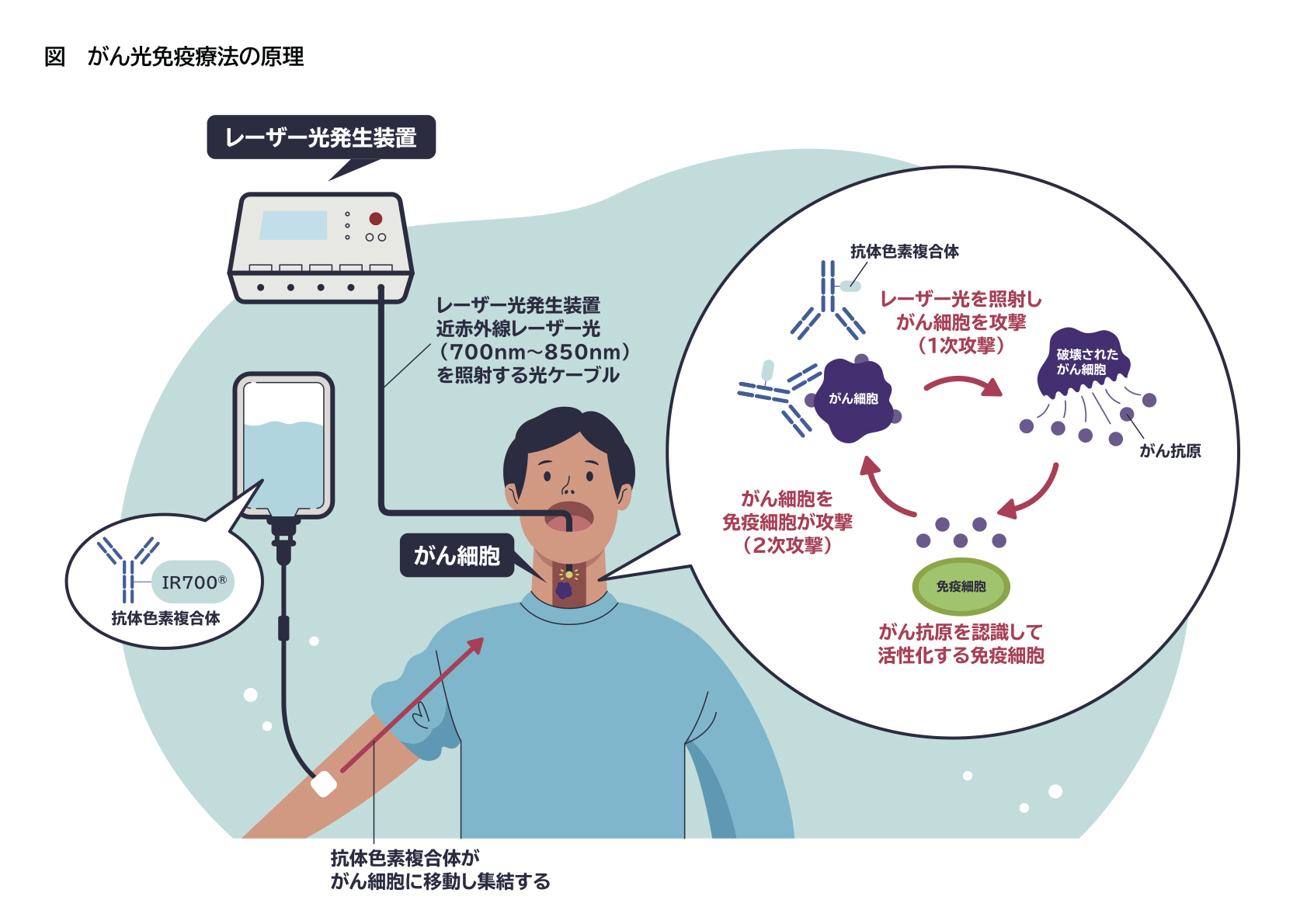
“1次攻撃”ではがん抗原を標的に抗体色素結合体とレーザー光照射でがん細胞を選択的に攻撃する。破壊されたがん細胞から放出されたがん抗原が周囲の免疫細胞を活性化し、わずかに生き残ったがん細胞を掃討して“2次攻撃”が成立する。
光免疫療法は楽天メディカル社により臨床開発が進み、2020年9月にがん局所治療医薬品「アキャルックス®点滴静注250mg」と医療機器レーザー装置「BioBlade®レーザシステム」(写真)の双方について製造販売承認を取得し、同年11月には「切除不能な局所進行又は局所再発の頭頸部癌」を適応に保険収載され、日本国内での治療が始まりました。これは世界で初めての実用化でした。
実は、日本に研究拠点を置く理由の1つが、この日本国内で世界に先駆けて実臨床が開始されたことにあります。実臨床で得られるデータは、多くの制約のもとで実施される臨床研究や治験から得られるデータをはるかに凌ぎます。新しい治療法なので、実臨床からリアルなデータを集めることができれば、治療の改良に還元できます。米国では優先審査の対象になってはいますが承認されておらず、日本が米国を追い越したと言えるでしょう。
また先ほど述べたように、関西医科大学では既に2021年の段階で光免疫療法センターを設置しています。附属病院の耳鼻咽喉科・頭頸部外科の岩井大教授がセンター長に就任し、頭頸部がんの症例を集積している最中です。これで関西医科大学がいう“臨床と研究の両輪”が期待できるのです。
実臨床から得られた情報を有効活用するために、光免疫医学研究所では「基盤開発部門」「免疫部門」「腫瘍病理部門」を設置しています。血液などから得られる免疫情報や病理標本を収集、治療の前後で比較し、後々の治療方針や技術の改良に役立たせる計画となっています。
 (写真)BioBlade®レーザシステム
(写真)BioBlade®レーザシステム
今後の光免疫療法がより多くのがんで治癒率の高い治療へと進化していくためには2つの面からの研究が必要です。1つは免疫の増強であり、もう1つはより体の深部に正確にレーザー光を照射する医療機器の改良です。
免疫増強のためには、その担い手となるT細胞を効率良く働かせることが必要になるので、インターロイキン15のようなT細胞を増殖させ長生きさせる物質(T細胞増殖因子)との併用がカギを握っています。
一方で体の中には、過剰な免疫反応を抑制させる免疫チェックポイント分子やT細胞の働きを抑制する制御性T細胞(Treg)などが存在します。つまり、有効なT細胞を増やすこととともに、T細胞の働きを抑制するものの排除が必要になってきます。前者のためにはT細胞増殖因子を光免疫療法と併用し、後者のためには免疫チェックポイント分子を阻害する薬剤やTregを標的とした新たな抗体色素複合体の導入を検討していく必要があります。
医療機器の改良も重要です。光免疫療法で使用するレーザーは、高出力のものは不要で、低出力なダイオードレーザーで十分です。従って、“光源の強さ”というよりも“光をどのように当てるか”が大切です。
今後、膵臓がんや胆管がんなど身体の内部に発生するがんを標的とするためには、体内でがん細胞の近くに光源を正確に設置する技術の進歩や、がん細胞にレーザーを照射する光ファイバー自体を改良していかなければなりません。光ファイバーも患者さんの状況に応じて様々な照射範囲のものを用意しなければならないと思いますし、刺入するときに使うカテーテルにも個別化医療の考え方が必要です。
医療機器・材料のトップランナーの方々は幸いなことに日本国内に数多く存在するため、トップランナーを有する国内の様々な企業と共同でレーザー光の照射技術の改良に取り組んでいます。
2022年4月に、楽天メディカルは「頭頚部への光免疫療法(頭頸部アルミノックス治療)が提供可能な施設が32都道府県の62施設に広がった」と発表しました。同社が主催する講習プログラムを受け、本治療の医師要件を満たした医師も165名に増えています。
まだ限られた施設と特別の知識を得た医師にのみ許されている治療法ですが、将来は街のクリニックや歯科医などでも治療ができるようになると考えています。レーザー光を照射する機器はすでに小型で持ち運びができるので、初発の元気な患者さんへの適応が拡大できるようになればクリニックや歯科医でも使えます。口腔がんを歯科医が治療するケースもあり、医師のみならず歯科の先生にも使ってもらえるように今後も光免疫療法の改良を続けたいと思っています。