
发布日期:2023.01.06
继上次医药品的药事承认结构之后,这次将根据最近的动向介绍医疗器械的药事承认结构。
要在市场上销售医疗设备,必须按照药物法(关于确保医药品、医疗器械等的质量、有效性和安全性的法律)中的规定对医疗设备进行分类,并按照分类对医疗设备进行审查、认证和批准。医疗器械的承认和认证,是从制造销售的医疗器械的品质、有效性、安全性等观点出发,审查作为医疗器械是否有问题而给予的。
医疗器械按用途划分的话,大致分为 (1) 预防 (检查) (2) 诊断 (3) 治疗 (4) 康复4种。(1) 预防 (检查) 设备包括心电图仪,血压计,血液检测设备等。(2) 诊断仪器包括内窥镜、X光机、超声波诊断仪、X线-CT、MRI、PET等。(3) 治疗设备包括激光刀,起搏器,人工心脏,支架移植物,人工透析装置,人工心肺装置,人工骨头等。(4) 作为康复器械,自动牵引装置、微波治疗器、按摩器等属于这种情况。这些医疗器械受药械法规的约束,但医疗场所使用的医用口罩和塑料手套等被视为杂货 (杂项) ,不受药械法规的约束。
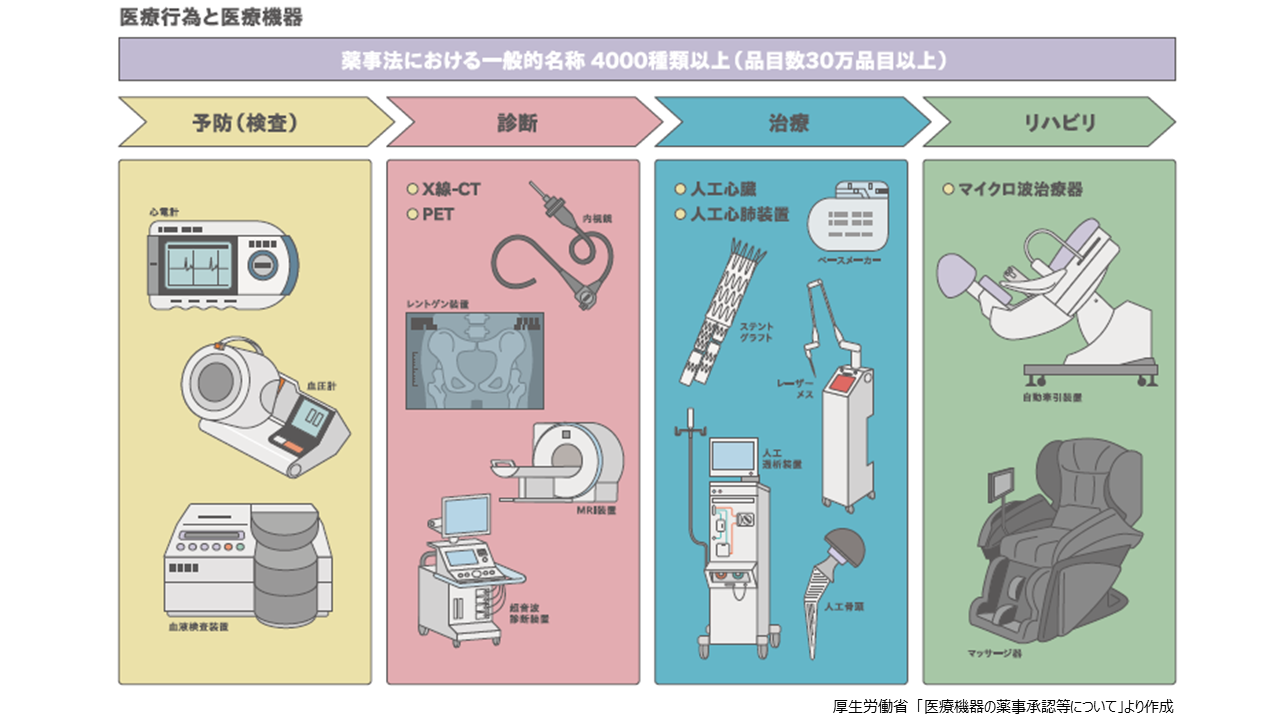
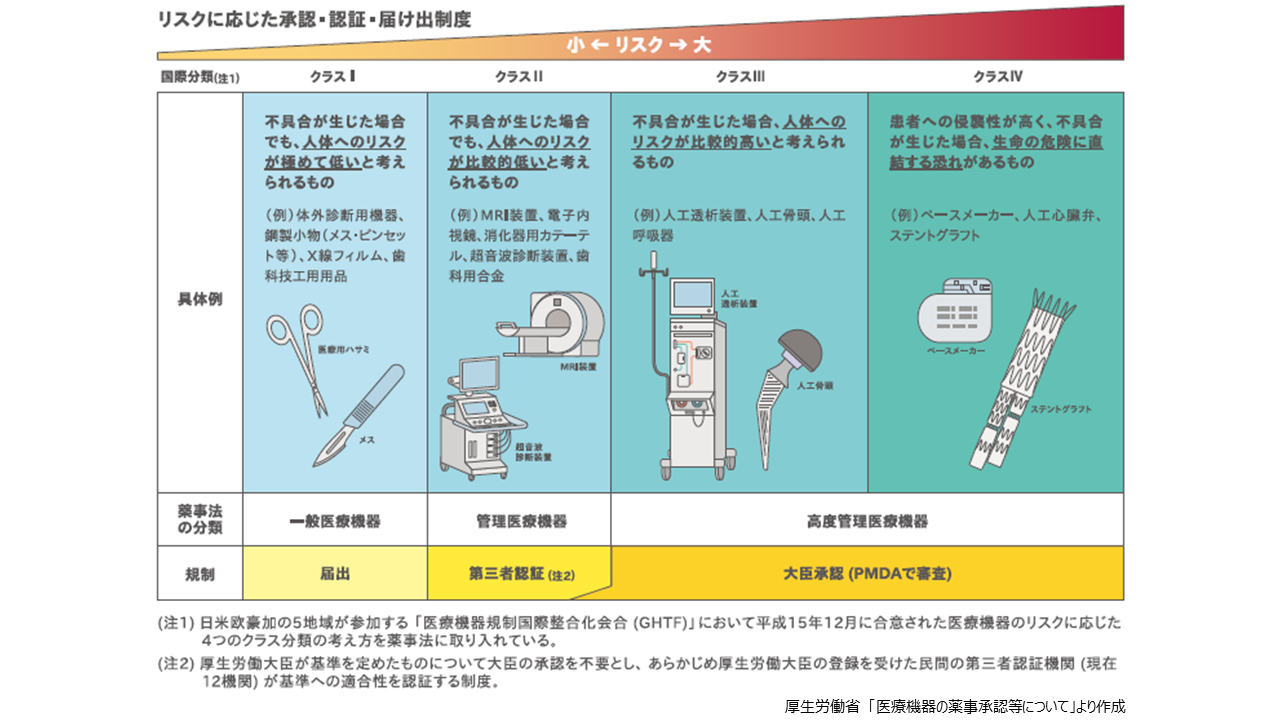
根据药机法的等级是根据医疗器械对人体的风险大小来分类的。所需的手续根据相应的等级而不同。一般医疗设备 (国际分类:I类) 即使出现问题,也被认为对人体的风险极低,包括体外诊断设备、钢制配件 (如手术刀和镊子) 、医疗纱布、脱脂棉、X射线增敏纸和牙科印模材料。这些设备在向医药品医疗器械综合机构 (PMDA) 提出申报时即可开始制造销售。管理医疗设备 (同:II级) 在出现问题时对人体的风险相对较低,包括磁共振成像工作站、眼科内窥镜、支气管导管、超声血流计和牙科金属。对于这些设备,有必要在制造和销售时向由厚生劳动大臣注册的私人第三方认证机构申请认证并获得认证。
高级管理医疗设备可分为III级和IV级, III级在出现问题时对人体的风险相对较高,包括中空透析器、人工关节、麻醉呼吸机和眼科微导管。此外, IV级对患者的侵入性很高,如果出现问题,可能会直接导致生命危险,包括植入式心脏起搏器、冠状动脉支架和主动脉支架移植物。这些设备需要向PMDA申请批准。PMDA对医疗器械的质量、有效性、安全性进行审查,向药事和食品卫生审议会进行咨询和报告后,厚生劳动省批准药事。
另外, PMDA将其分类为: (1) 新医疗器械(与已批准生产销售的医疗器械在结构、使用方法、效果、性能上有明显差异); (2) 改良医疗器械 (新医疗器械或仿医疗器械均不适用) ; (3) 仿医疗器械(与已批准的医疗器械在结构、使用方法、效果、性能上基本相同)。
审查所需的附加材料涉及规格设置,稳定性,功效,风险分析,制造方法,临床试验结果等(根据申请的医疗器械的不同,所需的资料和试验也不同,所以根据医疗器械的不同,也有不需要的资料。)。
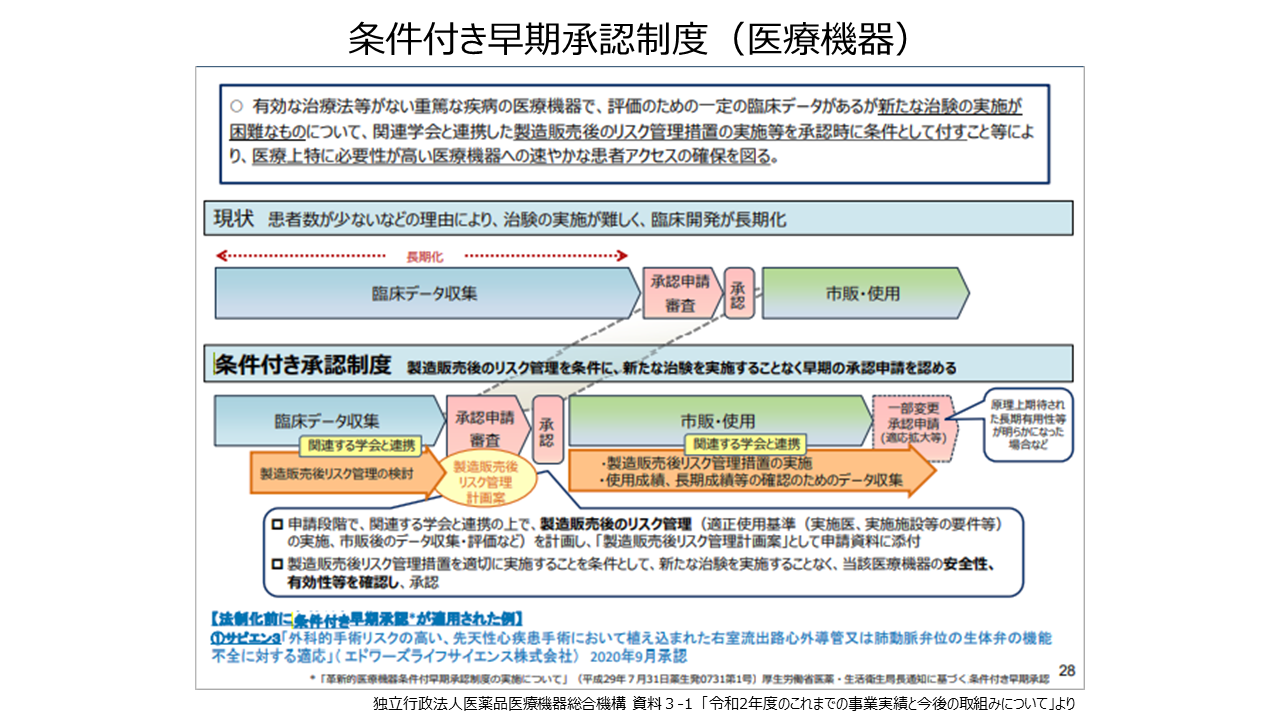
对于没有有效治疗方法的严重疾病的医疗器械,虽然有一定的临床数据,但由于患者数量少等原因而难以实施新的临床试验的医疗器械,有与相关学会合作的制造销售后的风险管理措施的实施等作为批准时的条件,以确保患者迅速进入的“有条件的早期批准制度”。用于TPVI (经导管肺动脉瓣治疗) 的球囊扩张型人工心脏瓣膜“Edwards Sapien 3”,旨在重新治疗植入肺动脉瓣位的导管和外科生物瓣膜。最近,还开发了使用AI开发的医疗设备 (内窥镜图像诊断支持软件) 和行为改变应用程序 (戒烟治疗辅助系统) ,并且正在促进其检查的加速和透明度。我会的。
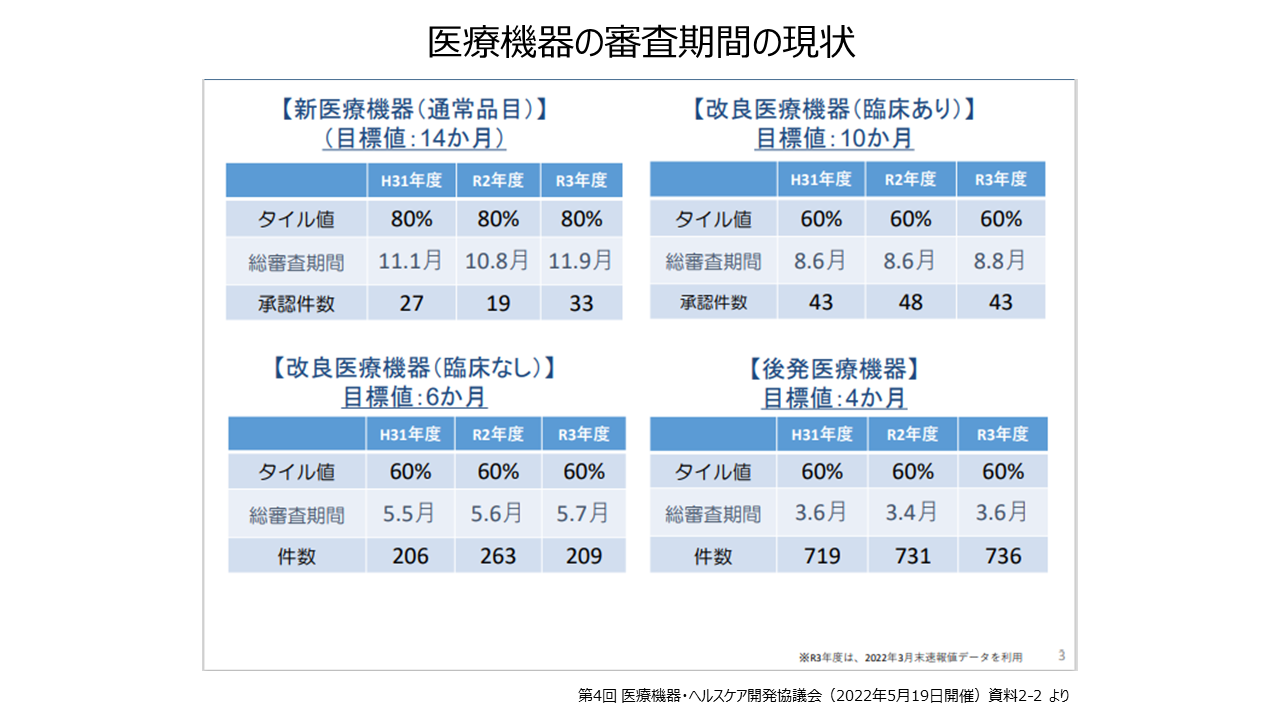
2021年医疗器械年度批准数量为新医疗器械(正规产品)33个,改进型医疗器械(有临床试验)43个,改进型医疗器械(无临床试验)209个,仿制医疗器械736个。这是一个问题。
新医疗器械的审评周期为 11.9 个月(80% 瓦值),仿制医疗器械为 3.6 个月(60% 瓦值)。具有行为改变功能的程序化医疗器械获批数量从2015年的9个增加到2019年的36个。
缩短医疗设备投入实际使用的时间对于等待它的患者是有益的,对于公司来说,这是一个促进业务发展的好材料。
MEDIUS Group 正在发展以销售医疗设备为中心的业务。参与医疗的我们(Medical + us)也想扮演一个信息源(Media)的角色,为医疗领域和人们明天的健康提供有用的信息。